Myyntilupien lukumäärät (myyntilupia voimassa) 2020-2024 saavutettavassa muodossa (pdf).
Lääkkeiden ja lääkinnällisten tuotteiden saatavuuden edistäminen

YK:n kestävän kehityksen tavoite 3:

3.4 Vähentää vuoteen 2030 mennessä kolmanneksella tarttumattomien tautien aiheuttamia ennenaikaisia kuolemia ennaltaehkäisyn ja hoidon avulla sekä edistää henkistä terveyttä ja hyvinvointia.
3.8 Saavuttaa yleiskattava terveydenhuolto, mukaan lukien turva taloudellisilta riskeiltä, pääsy laadukkaiden ja olennaisten terveydenhoitopalvelujen piiriin sekä turvalliset, tehokkaat, laadukkaat ja edulliset välttämättömät lääkkeet ja rokotukset kaikille.
Haaste
Yhdistyneet Kansakunnat (YK) ja Maailman terveysjärjestö (WHO) on asettanut sydän- ja verisuonisairauksiin, syöpiin, diabetekseen ja hengityselinsairauksiin liittyvän kuolleisuuden yhdeksi terveellisen elämän ja hyvinvoinnin indikaattoriksi. Suomessa sydän- ja verisuonisairaudet, diabetes, astma ja allergia sekä syöpäsairaudet katsotaan kroonisiksi kansantaudeiksi. Asianmukainen lääkehoito auttaa hallitsemaan kroonisen sairauden oireita ja hidastamaan niiden etenemistä sekä parantaa sairastuneen elämänlaatua.
Nykyinen maailman tilanne aiheuttaa haasteita lääkkeiden ja lääkinnällisten tuotteiden saatavuudelle. Pandemian jälkivaikutukset, kysynnän vaihtelut, uudet tuotantovaatimukset sekä tilapäiset tuotannon keskeytykset ovat esimerkkejä saatavuuteen vaikuttavista tekijöistä. Katkokset lääkkeiden saatavuudessa eivät useimmiten näy potilaalle asti, sillä usein saatavilla on vastaava, lääkevaihdon piirissä oleva, valmiste, jonka apteekki voi toimittaa.
Lääkkeen myyntiluvanhaltijan eli lääkeyrityksen vastuulla on huolehtia, että myyntiluvan saanutta valmistetta on jatkuvasti lääkkeiden tukkukauppojen ja apteekkien saatavissa potilaiden ja muiden käyttäjien tarpeisiin. Tämä on myös lääkkeen myyntiluvan myöntämisen yhteydessä oleva lakisääteinen ehto.
Fimean rooli
Fimean tehtävänä on lääkkeiden sekä niiden valmistuksen ja jakelun asianmukaisuuden varmistaminen. Fimea myöntää myyntilupia ihmis- ja eläinlääkkeille sekä valvoo lääkinnällisten laitteiden vaatimustenmukaisuutta ja alan toimijoita Suomessa. Lisäksi Fimea varmistaa apteekkipalveluiden riittävyyttä, lääkkeiden toimitus- ja jakeluvarmuutta sekä hintakilpailun toimivuutta kuluttajan aseman turvaamiseksi.
Fimean tavoite
Fimean tavoitteena on edistää kestävällä tavalla kansalaisten terveyttä ja hyvinvointia. Lisäksi tavoitteena on, että turvalliset, laadukkaat sekä edulliset lääkkeet ja lääkinnälliset tuotteet ovat kansalaisten saatavilla, kun niitä tarvitaan. Fimea pyrkii olemaan ensisijainen ja ajantasainen tiedonlähde saatavuushäiriöistä. Tavoitteena on, että lääkkeiden ja lääkinnällisten tuotteiden saatavuushäiriöt vaikuttaisivat kansallisella tasolla potilashoitoihin mahdollisimman vähän.
Miten tavoitteiden saavuttamista edistetään Fimeassa?

| Lääkevalmiste Järjestä taulukko sarakkeen mukaan nousevasti | 2020 Järjestä taulukko sarakkeen mukaan nousevasti | 2021 Järjestä taulukko sarakkeen mukaan nousevasti | 2022 Järjestä taulukko sarakkeen mukaan nousevasti | 2023 Järjestä taulukko sarakkeen mukaan nousevasti | 2024 Järjestä taulukko sarakkeen mukaan nousevasti |
|---|---|---|---|---|---|
| Ihmislääke | 9 584 | 9 867 | 10 059 | 10 311 | 10 757 |
| Eläinlääke | 1 131 | 1 163 | 1 192 | 1 215 | 1 278 |
| Yhteensä | 10 715 | 11 030 | 11 252 | 11 526 | 12 035 |
Lääkeyritykset vastaavat lääkkeiden saatavuudesta ja markkinoille tuonnista. Fimea valvoo ja selvittää mahdollisia saatavuushäiriöitä yhteistyössä lääkeyritysten kanssa. Fimea ylläpitää ajankohtaista luetteloa lääkkeiden saatavuushäiriöistä verkkosivuillaan ja tiedottaa tarvittaessa erillisillä verkkotiedotteilla. Saatavuustietoja jaetaan säännöllisesti lääkealan toimijoiden, sosiaali- ja terveysministeriön sekä EU:n ja Pohjoismaiden lääkeviranomaisten edustajien kanssa.
| Suorite Järjestä taulukko sarakkeen mukaan nousevasti | 2020 Järjestä taulukko sarakkeen mukaan nousevasti | 2021 Järjestä taulukko sarakkeen mukaan nousevasti | 2022 Järjestä taulukko sarakkeen mukaan nousevasti | 2023 Järjestä taulukko sarakkeen mukaan nousevasti | 2024 Järjestä taulukko sarakkeen mukaan nousevasti |
|---|---|---|---|---|---|
| Saatavuushäiriöilmoitukset | 2 093 | 1 710 | 2 335 | 2 849 | 2 676 |
| Velvoitevarastointipäätökset | 391 | 313 | 478 | 494 | 486 |
| Velvoitevarastoinnin alituslupapäätökset | 312 | 270 | 441 | 450 | 448 |
| Saapuneet poikkeuslupahakemukset (ihmislääkkeet)* | 198 | 125 | 175 | 200 | 274 |
| Poikkeuslupapäätökset (ihmislääkkeet)* | 189 | 107 | 152 | 186 | 254 |
| Saapuneet poikkeuslupahakemukset (eläinlääkkeet)* | 33 | 49 | 60 | 46 | 20 |
| Poikkeuslupapäätökset (eläinlääkkeet)* | 31 | 46 | 53 | 39 | 19 |
| Potilaskohtaiset erityislupapäätökset | 7 327 | 6 809 | 7 402 | 8 917 | 8 805 |
| Laitoskohtaiset erityislupapäätökset | 8 465 | 7 730 | 8 019 | 7 926 | 7 598 |
| Määräaikaiset erityislupapäätökset | 110 | 81 | 74 | ||
| Lääkinnällisiin laitteisiin liittyvät poikkeusluvat (MD-asetus ja IVD-asetus) | 1 | 14 | 10 | 6 |
Fimea seuraa eri suoritteita, jotka vaikuttavat lääkkeiden saatavuuteen, esimerkiksi saatavuushäiriöilmoituksia, lääkevalmisteiden velvoitevarastoinnin alituslupamääriä sekä poikkeuslupa- ja erityislupamääriä.
* Poikkeuslupien osalta laskentatapa on muuttunut, minkä vuoksi vuoden 2022 jälkeiset lukemat eivät ole suoraan vertailukelpoisia aikaisempien vuosien määriin.
- Fimea huolehtii osaltaan terveydenhuollon tarvitsemasta kattavasta lääkevalikoimasta, seuraa myönnettyjen myyntilupien määriä ja lääkkeiden hintapolitiikkaa. Fimea julkaisi maaliskuussa 2024 edeltävänä syksynä toteutetun Lääkebarometri 2023 -väestökyselyn tulokset. Lääkebarometrissa seurataan esimerkiksi sitä, kuinka suurella osalla väestöstä on taloudellisia vaikeuksia hankkia lääkkeitä. Viimeisen kahdeksan vuoden aikana osuus on kasvanut 16 prosentista 24 prosenttiin.
Fimea laatii ja ylläpitää luetteloa keskenään vaihtokelpoisista lääkevalmisteista. Luettelon avulla lääke voidaan apteekissa vaihtaa edullisempaan vaihtokelpoiseen lääkkeeseen. Lääkevaihdon tarkoitus on lisätä hintakilpailua ja vähentää lääkekorvauskustannuksia. Hinnaltaan edullisempien lääkevalmisteiden käyttö hyödyttää paitsi yhteiskuntaa taloudellisesti myös väestöä terveydellisesti, koska useammalla lääkkeen käyttäjällä on vara hankkia tarvitsemansa lääkkeet.
| Summa Järjestä taulukko sarakkeen mukaan nousevasti | 2019 Järjestä taulukko sarakkeen mukaan nousevasti | 2020 Järjestä taulukko sarakkeen mukaan nousevasti | 2021 Järjestä taulukko sarakkeen mukaan nousevasti | 2022 Järjestä taulukko sarakkeen mukaan nousevasti | 2023 Järjestä taulukko sarakkeen mukaan nousevasti |
|---|---|---|---|---|---|
| Yhteensä, milj. euroa | 75,5 | 75,1 | 78,2 | 102,3 | 114,8 |
| Säästö/vaihto, euroa | 19,0 | 18,2 | 16,7 | 21,2 | 23,2 |
Lähteet: Kelan aineisto Sairausvakuutuksesta korvattavat lääketoimitukset. Hinta- ja viitehintatiedot Lääketietokannan tiedoista. Korvaukset sisältävät lisäkorvaukset. Tilasto kattaa myös ennen alkuomavastuun täyttymistä tehdyt ostot.
Lääkkeen vaihtamisen tuomat säästöt vuosina 2019-2023 saavutettavassa muodossa (pdf).
Tapausesimerkki: biologisten lääkkeiden lääkevaihdon aloittaminen vuonna 2024
Biologisten lääkkeiden lääkevaihto tuli mahdolliseksi vuonna 2024. Lääkevaihto apteekeissa toteutetaan porrastetusti ja aloitettiin huhtikuussa 2024 veritulppien hoitoon ja ehkäisyyn käytettävällä lääkevalmisteella. Fimea määrittelee keskenään vaihtokelpoiset biologiset lääkkeet neljä kertaa vuodessa.Fimea viestitti vuoden 2024 aikana laajasti biologisten lääkkeiden apteekkivaihdon voimaantulosta. Fimea lähetti apteekeille ohjauskirjeen sekä järjesti webinaarin. Lisäksi lääkevaihdosta järjestettiin viestintäkampanjoita lääkkeen määrääjille ja potilaille. Fimea kehitti käytettävissä olevaa tietopohjaa ja pilotoi biologisten lääkkeiden antolaitevideoiden tuotantoa. Lisäksi Fimea alkoi ylläpitää apteekkien lääkeneuvonnan tueksi ”Apteekin valmistekohtainen ohjaus” -tietokannassa tietoa keskenään vaihtokelpoisten biologisten lääkkeiden oleellisimmista eroista, kuten antolaitteiden toiminnasta.
- Fimea on ollut mukana kehittämässä biosimilaarivalmisteiden laadunvarmistuksessa käytettäviä EMAn toimeksiantamia valvontaohjelmia, ja Fimean laboratorion johdolla valmisteltiin yksi biosimilaarien testausohjelma vuonna 2024.
- Vuoden 2024 syksyllä aloitettiin lääkkeiden saatavuuden ja varautumisen tilannekuvan raportoinnin kehittäminen. Tietoja eri lähteistä, kuten saatavuushäiriöilmoituksista, on koottu raporteiksi kansallisten ja EU:n viranomaisten tarpeisiin.
- Fimea osallistui aktiivisesti CHESSMEN-yhteistoimintahankkeeseen EU:n lääkevirastojen kanssa. Hankkeen tavoitteena on harmonisoida parhaat käytänteet lääkkeiden saatavuushäiriöiden ehkäisemiseksi ja vaikutusten vähentämiseksi. Fimea johti hanketta ja jatkoi osallistumista EU:n kriittisten lääkkeiden arviointiin.
- Lääkinnällisten laitteiden valvonnassa edistettiin saatavuusraportointia. Uuden asetuksen myötä lääkinnällisten laitteiden valmistajien täytyy raportoida valvovalle viranomaiselle, jos he ennakoivat laitteen toimituksen keskeytymistä tai loppumista, mikä voisi aiheuttaa vakavaa haittaa potilaille tai kansanterveydelle. Fimea osallistui työryhmään, joka laati raportointiprosessin, lomakkeen ja ohjeet, jotta raportointivelvoite saatiin toimimaan asetuksen mukaisesti tammikuussa 2025. Saatavuusraportoinnilla saadaan ennakoivaa tietoa lääkinnällisten laitteiden valmistajilta, jotta potilaiden ja terveydenhuollon ammattilaisten saatavilla on vaatimustenmukaisia lääkinnällisiä laitteita.
- Fimeassa käynnistyi viiden vuoden pilotti, jossa voidaan hyväksyä yhteispohjoismaiset, englanninkieliset pakkaukset tietyille pienimenekkisille, mutta elintärkeille sairaalavalmisteille. Kun tällä tavoin yksinkertaistetaan tuotantoa, voidaan parantaa tiettyjen kriittisten valmisteiden saatavuutta pohjoismaissa. Fimea myöntää Suomessa myyntiluvattomalle lääkevalmisteelle erityisluvan, jos potilaan hoitoon ei ole Suomessa saatavilla myyntiluvallista valmistetta. Vuonna 2024 Fimea kehitti sähköisen ERKKA-järjestelmän erityislupien hakemiseen ja käsittelyyn. Tämä järjestelmä otettiin käyttöön helmikuussa 2025. Samalla uudistettiin Fimean Lääkehaku, jossa voi nyt hakea myös erityislupaa edellyttäviä valmisteita.
| Vuosi Järjestä taulukko sarakkeen mukaan nousevasti | 2021 Järjestä taulukko sarakkeen mukaan nousevasti | 2022 Järjestä taulukko sarakkeen mukaan nousevasti | 2023 Järjestä taulukko sarakkeen mukaan nousevasti | 2024 Järjestä taulukko sarakkeen mukaan nousevasti |
|---|---|---|---|---|
| Lääketehtaat GMP | 30 | 31 | 34 | 40 |
| Veripalvelutoiminta | 4 | 6 | 5 | 7 |
| Sairaala-apteekit ja lääkekeskukset | 18 | 18 | 14 | 13 |
| Apteekit ja sivuapteekit | 28 | 36 | 55 | 55 |
| Lääketukkukaupat | 25 | 27 | 26 | 29 |
| Kudoslaitokset | 25 | 25 | 22 | 22 |
| Elinluovutus- ja elinsiirtotoiminta | 0 | 6 | 6 | 6 |
| Lääkinnällisten laitteiden valmistajien tarkastus | 9 | 9 | 19 | 19 |
| Lääkinnällisten laitteiden valtuutettujen edustajien, maahantuojien ja jakelijoiden tarkastus | 2 | 3 | 4 | 11 |
| Kliinisten laitetutkimuksien tutkimuspaikan tarkastus | 0 | 2 | 1 | 2 |
| Ilmoitettuun laitokseen kohdistuva vuosittainen valvonta | 3 | 3 | 3 | 5 |
| Sterilointipalveluiden tuottajaan kohdistuva tarkastus | 0 | 0 | 0 | 0 |
Vuonna 2024 Fimea teki aiempia vuosia enemmän lääketeollisuuden tarkastuksia. Tarkastusmäärien kasvussa näkyvät sekä uusien lääkkeiden tulo markkinoille että kotimaan lääketeollisuuden merkittävät rakennus- ja laajennushankkeet. Fimean valvontaan tuli vuonna 2024 seitsemän uutta lääketehdasta EU:n ulkopuolelta ja kuusi kotimaan lääketehdastarkastusta liittyi mittaviin rakennushankkeisiin tai uusien tehdaslupien hakemiseen. Fimean tarkastamat tehtaat valmistavat sekä steriilejä lääkkeitä (muun muassa syöpälääkkeitä, insuliinia, psyyken lääkkeitä, ehkäisimiä, geeniterapialääkkeitä ja rokotteita) että epästeriilejä lääkkeitä (muun muassa tabletteja, inhalaatioita ja laastareita). Fimea tarkastaa myös lääkkeiden vaikuttavien aineiden valmistajia EU:n ulkopuolella osana EDQM:n tarkastusohjelmaa, mitä EU:n lääkevirastot eivät muuten rutiininomaisesti tarkasta.
Tarkastusten lukumäärät valvonta-alueittain vuosina 2021-2024 saavutettavassa muodossa (pdf).
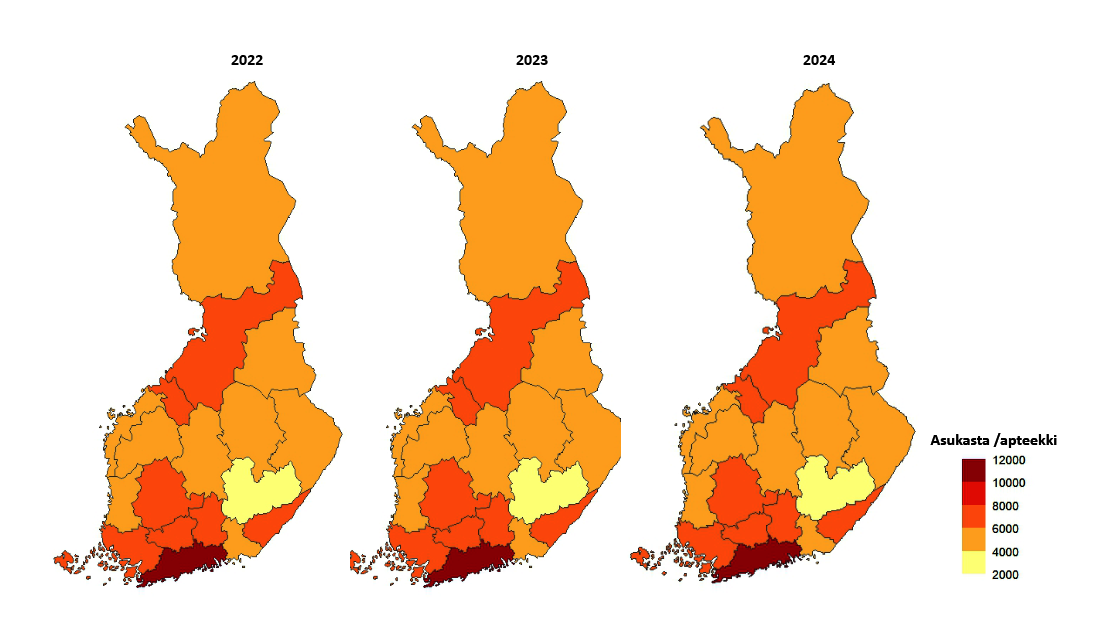
- Suomessa toimi 31.12.2024 yhteensä 648 apteekkia ja 185 sivuapteekkia. Toimintansa aloitti yhdeksän uutta apteekkia.
- Fimea kerää säännöllisin väliajoin tietoa väestön kokemuksista lääkkeiden saatavuudesta, jotta voidaan varmistaa muun muassa Suomen apteekkiverkon kattavuus. Lääkebarometri-väestökyselyyn vastasi yli 2 000 aikuisikäistä suomalaista, joista 92 prosenttia koki apteekkeja olevan riittävän lähellä, jotta lääkkeitä saa vaivattomasti. Vain harva koki lääkkeiden hankinnan vaikeaksi vähäisten ostopaikkojen vuoksi. Neljäsosa vastaajista (26 prosenttia) oli kuitenkin ollut usein tilanteessa, jossa olisi tarvinnut lääkettä apteekin ollessa kiinni.
- Fimea valvoo lääkkeiden velvoitevarastointia, joka turvaa Suomessa lääkkeiden saatavuuden häiriötilanteissa. Tarvittaessa velvoitevarastointivelvolliselle voidaan myöntää lupa varastovelvoitteen alittamiseen lääkkeiden jatkuvan saatavuuden turvaamiseksi. Velvoitevarastoinnin toteutumista valvotaan tarkastuksilla.
Fimea osallistui vuonna 2024 kansalliseen lääkkeiden huoltovarmuutta edistävään työhön osallistumalla työryhmien toimintaan, käymällä vuoropuhelua lääkealan toimijoiden kanssa sekä erillisten STM:n toimeksiantojen mukaisesti. - Fimea on mukana kansallisessa varautumistoiminnassa. Fimea osallistui Poikkeusolojen neuvottelukunnan (PONK) toimintaan sekä lääkkeiden että lääkinnällisten laitteiden osalta. PONK on sosiaali- ja terveysministeriön asettama neuvottelukunta, jonka tehtävänä on edistää sosiaali- ja terveydenhuollon sekä ympäristöterveydenhuollon poikkeusoloihin varautumista. PONK:n lisäksi Fimea osallistui HVK:n eli Huoltovarmuuskeskuksen koordinoimaan pooli- ja sektoritoimintaan, jonka tavoite on kehittää huoltovarmuutta ja jatkuvuudenhallintaa yritysten ja organisaatioiden verkostossa. Vuonna 2024 Fimea osallistui HVK:n työryhmään, jonka tavoitteena oli lääkkeellisen hapen omatuotanto-oppaan laatiminen.
Verivalmisteiden huoltovarmuuden parantaminen on huomioitu valvontatoimien yhteydessä. Valmiusmenettelyitä on käsitelty toimijaa ohjaavan ministeriön kanssa. Vuonna 2024 on käynnistetty myös verivalmisteiden varautumissuunnittelu.
Valtakunnallinen varautumispäivä
Valtakunnallista varautumispäivää vietetään vuosittain 7. helmikuuta. Osallistuimme muiden viranomaisten mukana varautumispäivään. Muistutimme verkkosivuillamme ja sosiaalisen median kanavissamme kansalaisia siitä, että 72 tunnin kotivaraan kuuluu myös kotona olevan lääkekaapin asianmukaisuus. Reseptit tulisi muistaa uusia ajoissa ja kotona on hyvä olla muutaman päivän käyttöä vastaava määrä tarvittavia lääkkeitä sekä ensiaputarvikkeita. Lisäksi käytössä oleviin kriittisiin ja virtaa vaativiin lääkinnällisiin laitteisiin on oltava varavirtalähde sekä käytössä oleviin terveydenseurannan laitteisiin, kuten verenpainemittariin, paristoja.