Läkemedel med försäljningstillstånd i Finland
Genom systemet med försäljningstillstånd säkerställs effekten, säkerheten och kvaliteten hos de läkemedel som finns på marknaden.
Systemet med försäljningstillstånd tryggar läkemedelsanvändaren
Med läkemedel förebyggs eller behandlas sjukdomar. Innan ett läkemedelspreparat kan säljas till konsumenter beviljar läkemedelsmyndigheterna försäljningstillstånd efter att först ha försäkrat sig om dess effekt, säkerhet och kvalitet. Även efter inträdet på marknaden följs läkemedelspreparatet noggrant och produktinformationen uppdateras utifrån den säkerhetsinformation som samlas in under hela dess livscykel.
Läkemedelsföretaget ansöker om försäljningstillstånd för läkemedlet
Beslut om ansökan om försäljningstillstånd för läkemedel fattas alltid av läkemedelsföretaget och företag med verksamhetstillstånd ansvarar för att importera läkemedel till Finland.
Läkemedelsföretagen kan ansöka om försäljningstillstånd för sitt preparat i hela EU eller rikta sin ansökan till vissa enskilda länder.
Försäljningstillståndsförfarandet grundar sig på ansökningar om försäljningstillstånd som läkemedelsföretagen lämnat in. Läkemedelsföretaget ska med forskningsresultat visa att nyttan av läkemedelspreparatet är större än riskerna när läkemedlet används för det användningsändamål (behandling eller förebyggande av sjukdom), den målgrupp samt med den dosering och de andra användningsvillkor som läkemedelsföretaget föreslår.
Ansökan består av kliniska läkemedelsprövningar om effekten och säkerheten i faserna i den kliniska läkemedelsprövningen (faserna I-IV) hos frivilliga människor och av preklinisk dokumentation, dvs. undersökning av läkemedlets farmakologi före de kliniska prövningarna i provrörsförhållanden samt eventuellt genom djurförsök. För en läkemedelssubstans som redan används kan de ovan nämnda egna undersökningarna ibland också ersättas med hänvisningar till redan utförda undersökningar av ett annat liknande läkemedel eller till publicerad vetenskaplig litteratur. Dessutom ska läkemedelsföretaget genom omfattande tester visa att läkemedelspreparatet uppfyller de preparatspecifika kraven i fråga om kemisk och biologisk kvalitet.
Läkemedelsmyndigheten bedömer ansökan och beviljar försäljningstillstånd för läkemedlet när nyttan som preparatet medför bedöms vara större än riskerna (s.k. positivt nytto-riskförhållande).
Gemensamma förfaranden tillämpas inom EU/EES-området
I egenskap av Finlands försäljningstillståndsmyndighet arbetar Fimea tätt med EU/EES-ländernas nätverk för läkemedelstillsyn.
Inom EU/EES-området kan försäljningstillståndet för ett läkemedel vara antingen ett nationellt försäljningstillstånd som gäller endast en viss medlemsstat, ett försäljningstillstånd för erkännande eller ett decentraliserat förfarande som gäller flera stater samtidigt eller ett försäljningstillstånd för ett centraliserat förfarande som gäller hela EU-området. Ett centraliserat försäljningstillstånd som omfattar hela EU beviljas av Europeiska kommissionen på föredragning av Europeiska läkemedelsmyndigheten på basis av en utvärdering som utförs av expertteam vid de nationella läkemedelsverken som utsetts till uppgiften.
Enligt EU:s läkemedelslagstiftning hänvisas alla nya läkemedel och biologiska läkemedel till bedömning av Europeiska läkemedelsmyndigheten via ett centraliserat förfarande. I hälsonödsituationer kan försäljningstillstånd också beviljas villkorligt eller genom påskyndat förfarande (s.k. Rolling review).
Läkemedelspreparat avsedda för människor och djur bedöms separat i egna försäljningstillståndsprocesser.
Säkerhetsinformationen ökar under hela tiden läkemedlet finns på marknaden
Uppföljningen av läkemedelspreparaten fortsätter även under försäljningstillståndens giltighetstid. Särskilt informationen om säkerheten preciseras när läkemedlet används av stora patientgrupper. Vid behov görs ändringar i försäljningstillståndet enligt den nya informationen. Om det uppstår oro för säkerheten vid användningen av ett läkemedelspreparat kan användningsvillkoren begränsas eller andra säkerhetsåtgärder ökas.
Läkemedelsmyndigheten är mycket sällan tvungen att återkalla försäljningstillståndet för ett läkemedel av säkerhetsskäl. Den vanligaste orsaken till att försäljningstillståndet för ett läkemedelspreparat återkallas är att läkemedelsföretaget inte längre anser att det är lönsamt att hålla läkemedelspreparatet på marknaden.
För att trygga säkerheten hos användare av läkemedel gäller i Finland ett frivilligt ersättningssystem för läkemedelsskador: läkemedelsskadeförsäkringen. Försäkringen ersätter överraskande biverkningar av läkemedel som sålts eller överlåtits till konsumtion i Finland har orsakat användarna.
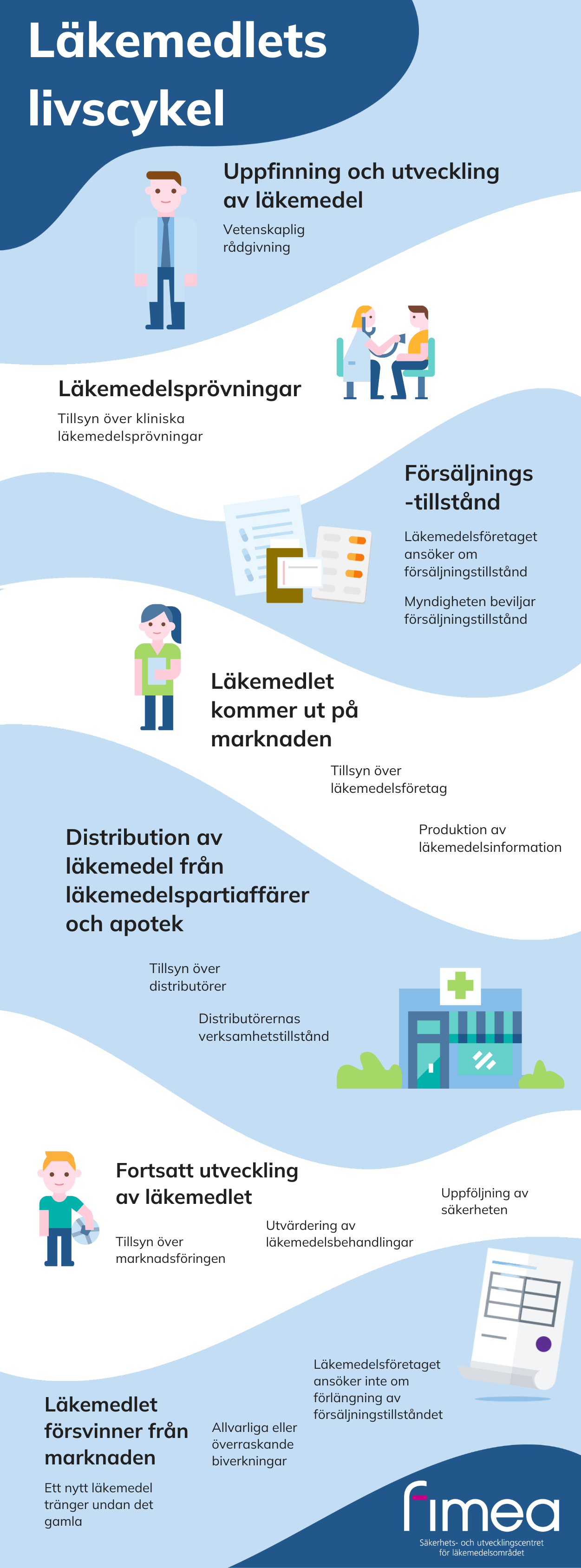
Läkemedlets livscykel
- Uppfinning och utveckling av läkemedel: vetenskaplig rådgivning
- Läkemedelsprövningar: tillsyn över kliniska läkemedelsprövningar
- Försäljningstillstånd: läkemedelsföretaget ansöker om försäljningstillstånd, myndigheten beviljar försäljningstillstånd
- Läkemedlet kommer ut på marknaden: tillsyn över läkemedelsföretag, produktion av läkemedelsinformation
- Distribution av läkemedel från läkemedelspartiaffärer och apotek: tillsyn över distributörer, distributörernas verksamhetstillstånd
- Fortsatt utveckling av läkemedlet: tillsyn över marknadsföringen, utvärdering av läkemedelsbehandlingar, uppföljning av säkerheten
- Läkemedlet försvinner från marknaden: ett nytt läkemedel tränger undan det gamla, allvarliga eller överraskande biverkningar, läkemedelsföretaget ansöker inte om förlängning av försäljningstillståndet
Läkemedelssöktjänst: i Läkemedelssöktjänsten hittar du information om alla läkemedelspreparat med försäljningstillstånd i Finland.
I webbtidningen Sic! 3-4/2017: Fimea varmistaa lääkkeiden saatavuutta (Julkari, på finska)